Παρά το γεγονός ότι τα χρονοδιαγράμματα στη διαδικασία τιμολόγησης και αποζημίωσης των καινοτόμων φαρμάκων έχουν βελτιωθεί αρκετά τα τελευταία έτη στη χώρα μας, το 58% των διαθέσιμων νέων θεραπειών στην Ελλάδα -μεταξύ των οποίων ογκολογικά και ορφανά φάρμακα για σπάνιες ασθένειες- βρίσκεται σε καθεστώς περιορισμένης διαθεσιμότητας ή αποζημίωσης, όπως αναφέρει μεταξύ άλλων έκθεση για τη διαθεσιμότητα των νέων καινοτόμων θεραπειών στην Ευρώπη.
Την ίδια στιγμή, η μέση διαθεσιμότητα των νέων καινοτόμων θεραπειών στην Ευρώπη στο 2022, φτάνει το 45%.Τα παραπάνω συμπεράσματα περιλαμβάνονται στην έρευνα για την εκτίμηση του δείκτη W.A.I.T. (Waiting to Access Innovative Therapies), που διενεργείται ετησίως από την Ευρωπαϊκή Ομοσπονδία Φαρμακευτικών Βιομηχανιών (EFPIA) με σκοπό την αποτύπωση του βαθμού πρόσβασης των ασθενών στις νέες καινοτόμες θεραπείες, ανάμεσα σε 37 χώρες της Ευρώπης.
i. Η έρευνα αφορά στα φάρμακα που έχουν εγκριθεί από τον ΕΜΑ τα προηγούμενα 4 χρόνια του κάθε έτους δημοσίευσης εκτιμώντας 2 βασικούς επιμέρους δείκτες:α) τη διαθεσιμότητα των νεών καινοτόμων θεραπειών (στην παρούσα έρευνα αυτά που είχαν ημερομηνία έγκρισης από τον Ευρωπαϊκό Οργανισμό Φαρμάκων εντός της περιόδου 2018-2022) ανά χώρα
β) τον χρόνο που περνά από την ημερομηνία έγκρισής τους από τον Ευρωπαϊκό Οργανισμό Φαρμάκων (European Medicines Agency, EMA) έως την ημερομηνία έναρξης της αποζημίωσή τους από τα συστήματα υγείας
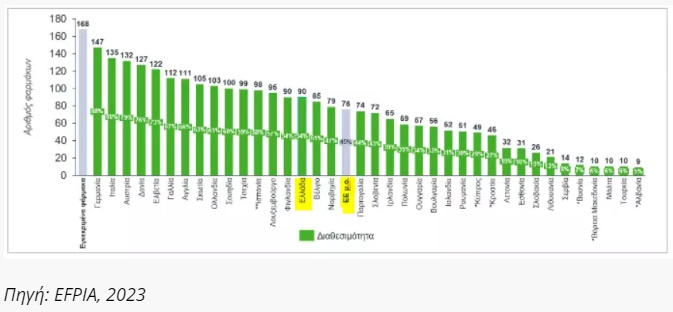
Σύμφωνα με την έρευνα, εκ των 168 φαρμάκων τα οποία έλαβαν έγκριση κυκλοφορίας την περίοδο 2018-2021, κατά μέσο όρο 76 φάρμακα ήταν διαθέσιμα στις χώρες της Ευρώπης που συμπεριλήφθηκαν στην μελέτη (Γράφημα 1).
Η μέση διαθεσιμότητα των νέων καινοτόμων φαρμάκων στην Ευρώπη εκτιμάται στο 45% για το έτος 2022 (50% για τα ογκολογικά φάρμακα και 39% για τα ορφανά φάρμακα).
Γραφημα 1. Βαθμός διαθεσιμότητας νέων καινοτόμων φαρμάκων στην Ευρώπη
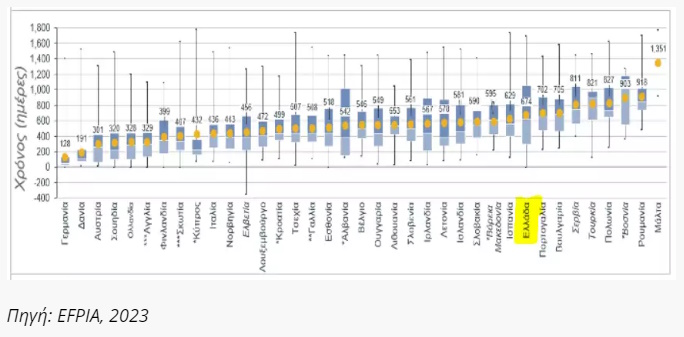
Αντίστοιχα, ο μέσος χρόνος για την αποζημίωσή τους από τα συστήματα υγείας στην Ευρωπαϊκή Ένωση υπολογίσθηκε στις 517 ημέρες, 6 ημέρες περισσότερες από το αντίστοιχο μέσο χρονικό διάστημα που είχε προκύψει από την ίδια έρευνα το περασμένο έτος (Γράφημα 2) (526 ημέρες για τα ογκολογικά φάρμακα και 625 ημέρες για τα ορφανά φάρμακα).
Γράφημα 2. Χρόνος από την κεντρική έγκριση (ΕΜΑ) έως την ένταξή καινοτόμων φαρμάκων στην λίστα αποζημίωσης
Το πρώτο συνολικό συμπέρασμα από τη μελέτη, είναι οι μεγάλες ανισότητες μεταξύ των χωρών της ΕΕ τόσο στη διαθεσιμότητα των φαρμάκων όσο και στο χρόνο που μεσολαβεί μεταξύ έγκρισης του ΕΜΑ και ένταξης των φαρμάκων στο σύστημα αποζημίωσης.
Στην Ελλάδα το 2022 περίπου το 54% των φαρμάκων που εγκρίθηκαν από τον ΕΜΑ μεταξύ 2018-2021 είναι διαθέσιμα για τους Έλληνες ασθενείς. Η χώρα μας εμφανίζει διαθεσιμότητα λίγο υψηλότερα του μέσου όρου της ΕΕ (47% ) και βρίσκεται περίπου μεταξύ των χωρών της δυτικής και βόρειας Ευρώπης, και των χωρών της κεντρικής και ανατολικής Ευρώπης (Γράφημα 1).
Ο σχετικός δείκτης για τα ογκολογικά και ορφανά φάρμακα εκτιμάται υψηλότερος και περί του 70% και 56%, αντίστοιχα και αυτό δείχνει ότι σε ότι αφορά τις σοβαρές ασθένειες οι ασθενείς στη χώρα μας έχουν πρόσβαση στα φάρμακα που αφορούν σε σοβαρές και απειλητικές ασθένειες.
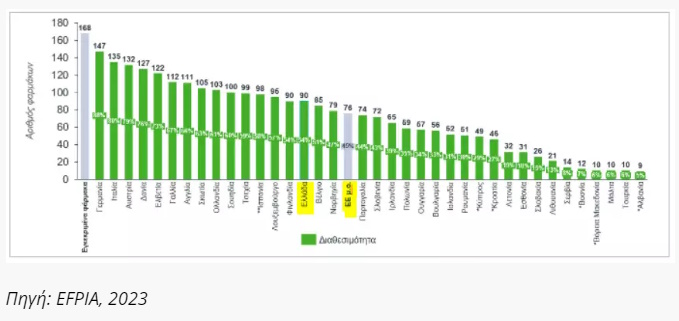
Ενώ η διαθεσιμότητα των νεών φαρμάκων εμφανίζεται ικανοποιητική συγκριτικά με τον σχετικό μέσο όρο, η πλειοψηφία των αποζημιούμενων φαρμάκων εμφανίζονται ως περιορισμένης (1) και όχι πλήρους διαθεσιμότητας (2).
Ειδικότερα, το 58% των διαθέσιμων νέων φαρμάκων στην Ελλάδα (έναντι ευρωπαϊκού μέσου όρου 31%), βρίσκεται σε καθεστώς περιορισμένης διαθεσιμότητας ή αποζημίωσης (66% και 68% των ογκολογικών και ορφανών φαρμάκων, αντίστοιχα) αντικατοπτρίζοντας κυρίως τα φάρμακα τα οποία διατίθενται μέσω του Συστήματος Ηλεκτρονικής Προέγκρισης (ΣΗΠ) (Γράφημα 3).
Αυτή η εικόνα της διαθεσιμότητας των φαρμάκων στους αποκαλύπτει τις ανισότητες στην πρόσβαση των ασθενών στην Ελλάδα σε νέες θεραπείες.
«Το σύστημα και οι σχετικές διαδικασίες δεν προσφέρουν καθολική πρόσβαση στις θεραπείες, καθώς η πρόσβαση των ασθενών εξαρτάται από την πρωτοβουλία του θεράποντος ιατρού, το αν τα νέα φάρμακα εντάσσονται σε κατηγορίες που μπορούν να διατίθενται μέσω ΣΗΠ, το καθεστώς χορήγησης του φαρμάκου τις συγκεκριμένες θεραπευτικές κατηγορίες στις οποίες μπορούν να ανήκουν οι ασθενείς», σχολιάζουν οι ερευνητές.
Γράφημα 3. Πλήθος φαρμάκων σε καθεστώς πλήρους και περιορισμένης διαθεσιμότητας
Αντίθετα, ενώ στην διαθεσιμότητα των νέων θεραπειών η Ελλάδα κινείται περίπου στο μέσο όρο της ΕΕ , στον χρόνο αποζημίωσης μιας νέας θεραπείας η χώρα εμφανίζεται να υστερεί σημαντικά του μέσου χρόνου στην Ε.Ε. καθώς αυτός υπολογίζεται ίσος με 674 ημέρες (έναντι 517 ημερών στις χώρες τις Ε.Ε.).
Αξίζει να σημειωθεί πως τόσο η μέση διαθεσιμότητά όσο και ο μέσος χρόνος αποζημίωσης των νεών φαρμάκων στην φετινή έρευνα επηρεάζονται από τις τεράστιες καθυστερήσεις που εμφανίσθηκαν στη χώρα μας τη διετία 2018-2019, ενώ είναι σίγουρο ότι στις έρευνες των επομένων ετών θα επηρεασθούν θετικά από την βελτίωση των χρονοδιαγραμμάτων αποζημίωσης της τελευταίας περιόδου στην χώρα όπως προκύπτει από πρόσφατη δημοσιευμένη μελέτη ii, αλλά και την εμπειρία από τη λειτουργία των αρμόδιων επιτροπών (ΕΑΑΦΑΧ και Διαπραγμάτευσης) ιδιαίτερα το περασμένο έτος.
Πέραν των ανωτέρω, η έρευνα αναλύει τους παράγοντες που διαμορφώνουν την διαθεσιμότητα αλλά και τον χρόνο ένταξης των νέων φαρμάκων στο πλαίσιο αποζημίωσης, οι οποίοι ταξινομούνται στις κατηγορίες:
α) χρόνος έγκρισης κυκλοφορίας (ΕΜΑ), β) διαδικασίες τιμολόγησης και αποζημίωσης, γ) διαδικασίες αξιολόγησης της αξίας των νεών φαρμάκων δ) περιορισμοί των συστημάτων υγείας και πόροι και ε) ύπαρξη διαδικασιών έγκρισης σε περιφερειακό και όχι εθνικό επίπεδο.
Εκτός των παραγόντων στις κατηγορίες α και ε οι οποίες δεν αφορούν στην Ελλάδα, στις υπόλοιπες κατηγορίες υπάρχει σημαντικό περιθώριο βελτίωσης της χώρας, παρά το γεγονός πως στην διαδικασία τιμολόγησης και αποζημίωσης τα χρονοδιαγράμματα – κυρίως – έχουν βελτιωθεί αρκετά τα τελευταία έτη.
Η προσοχή της πολιτικής υγείας οφείλει πρωτίστως να στραφεί στην χρηματοδότηση της φαρμακευτικής περίθαλψης η οποία χαρακτηρίζεται από σοβαρές στρεβλώσεις και ανεπάρκεια του συστήματος να ανταποκριθεί στις ανάγκες των ασθενών.
Όπως αποτυπώνεται σε πρόσφατη έρευνα του Ινστιτούτου Οικονομικών και Βιομηχανικών Ερευνών (ΙΟΒΕ) για το έτος 2021 iii, η κατά κεφαλήν δημόσια φαρμακευτική δαπάνη στην χώρα υπολείπεται σημαντικά του ευρωπαϊκού μέσου (243€ έναντι 321€) ενώ η ιδιωτική υπερβαίνει σημαντικά το αντίστοιχο μέσο μέγεθος (200€ έναντι 135€).
Η απόκλιση αυτή αποδίδεται στο γεγονός πως το 2021 η εξωνοσοκομειακή φαρμακευτική δαπάνη χρηματοδοτείται κατά το ήμισυ (50,4%) από δημόσιους πόρους καθώς το 33,3% αυτής χρηματοδοτείται από την φαρμακοβιομηχανία (μέσω υποχρεωτικών εκπτώσεων και επιστροφών) και το 16,4% από τους ασθενείς και η νοσοκομειακή φαρμακευτική δαπάνη χρηματοδοτείται επίσης κατά 50% από το σύστημα υγείας και το υπόλοιπο από την βιομηχανία.
Είναι σαφές πως η θέση της χώρας στην διαθεσιμότητα των νεών καινοτόμων θεραπειών αποδίδεται κυρίως στην ύπαρξη του ΣΗΠ ( περί του 58% των διαθέσιμων φαρμάκων) και στην χρηματοδότηση του 37% και 13% της συνολικής δαπάνης από την βιομηχανία και τους ασθενείς, αντίστοιχα.
Παρ’ όλα αυτά, απαιτούνται παρεμβάσεις πολιτικής υγείας για την μείωση των ανισοτήτων στην πρόσβαση των ασθενών στις θεραπείες, και αύξηση της δημόσιας χρηματοδότησης σε συνδυασμό με μέτρα ελέγχου της προσφοράς και ζήτησης για την μείωση των επιβαρύνσεων της βιομηχανίας και των ασθενών.
Τέλος, είναι σημαντικό να συνεχιστεί το θετικό και αποτελεσματικό έργο των διαδικασιών αξιολόγησης και διαπραγμάτευσης, ώστε να βελτιωθεί περαιτέρω ο μέσος χρόνος αποζημίωσης των νεών φαρμάκων.
1. Περιορισμένης διαθεσιμότητάς θεωρούνται τα φάρμακα τα οποία αποζημιώνονται:
α) σε συγκεκριμένους υποπληθυσμούς των εγκεκριμένων ενδείξεών τους,
β) κατά περίπτωση για κάθε ασθενή συνήθως μετά από σχετικό αίτημα και έγκριση και
γ) προσωρινά όσο εκκρεμεί η απόφαση ένταξής τους στην θετική λίστα
2. Για την πλειοψηφία των χωρών, πλήρης διαθεσιμότητα (full availability) θεωρείται η ένταξη των φαρμάκων στην θετική λίστα αποζημίωσης.
i European Federation of Pharmaceutical Industries, EFPIA (2023).
EFPIA Patients W.A.I.T. Indicator 2022 Survey. Διαθέσιμο στο:
https://www.efpia.eu/media/677293/efpia-patient-wait-indicator-final-report.pdf
ii
Chantzaras, A., Margetis, A., Kani, C., Koutsiouris, V., &
Bacopoulou, F. (2022). Time to Health Technology Assessment of New
Medicinal Products in Greece. Value in Health, 25(12), S342.
iii
Ινστιτούτου Οικονομικών και Βιομηχανικών Ερευνών (2021). Η Φαρμακευτική
αγορά στην Ελλάδα: Γεγονότα και Στοιχεία. Διαθέσιμο στο
http://iobe.gr/docs/research/RES_05_A_23062022_REP_GR.pdf







0 σχόλια :
Δημοσίευση σχολίου